
Genske škarje
Nobelova nagrada za kemijo 2020
Nobelovo nagrado za kemijo 2020 sta prejeli znanstvenici, Emmanuelle Charpentier z Max Planckovega inštituta v Berlinu in Jennifer Doudna s Kalifornijske univerze v Berkeleyju, za tehniko CRISPR/Cas9, popularno imenovano genske škarje. Te omogočajo izredno natančne posege v DNK številnih organizmov, tudi človeka. Odprle so do nedavnega neslutene možnosti zdravljenja raznih bolezni, gojenja novih rastlinskih vrst, pa tudi zaostrile vprašanje doslednega upoštevanja etičnih standardov.

Slika: Ko sta letošnji Nobelovi nagrajenki za kemijo začeli raziskovati imunski sistem bakterije Streptococus, vsaka v svojem laboratoriju, Emmanuelle Carpentier (levo) v Evropi in Jennifer Doudna (desno) v Kaliforniji, ju je gnala ideja po razvoju novega
Nagrado za kemijo loči od večine preostalih Nobelovih nagrad predvsem to, da sta jo omenjeni znanstvenici prejeli razmeroma hitro, prej kot v desetih letih po objavi prvega znanstvenega članka, ki je nakazoval to obetavno in daljnosežno tehniko genskega manipuliranja. To, čeprav dokaj redko kratko obdobje od prve znanstvene objave do Nobelove nagrade, ne preseneča. Genske škarje so namreč tako učinkovite in obenem dosegljive vsakemu običajno opremljenemu laboratoriju, da se je pomen njihovega odkritja pokazal z bliskovito naglico.
Drugo, kar morda v očeh laikov postavlja Nobelovo nagrado za kemijo v posebno luč, pa je dejstvo, da je bila enako kratka, kot je bila pot od prve znanstvene objave do nagrade, kratka tudi pot od ideje do odkritja. Za odkritjem te izjemno pomembne in daljnosežne tehnike namreč niso bili le načrtovani veliki projekti, ki bi jih presojali razni odbori, komisije, ni bilo ocen, prijav in kar vse je še danes povezano s tako rekoč vsakim raziskovalnim projektom. Bili so ideja, zanos, vztrajnost, intuicija in splet naključij, ki kažejo, da odkritja ne moreš vedno vnaprej predvideti.
Zmogljivo orodje, ki je še do nedavnega obstajalo le v pravljicah
Ko sta Nobelovi nagrajenki za kemijo pred leti začeli raziskovati imunski sistem bakterije Streptococus, vsaka v svojem laboratoriju, Emmanuelle Carpentier v Evropi in Jennifer Doudna v Kaliforniji, ju je gnala ideja po razvoju novega antibiotika. Namesto do novega antibiotika ju je njuno raziskovanje po prvem srečanju v kavarni v Portoriku privedlo do odkritja molekularnega orodja, s pomočjo katerega lahko molekularni biologi natančno zarežejo genski material in s tem razmeroma enostavno spremenijo kodo življenja.
Genske škarje omogočajo izredno natančne posege v DNK številnih organizmov, tudi človeka. Odprle so do nedavnega neslutene možnosti zdravljenja raznih bolezni in gojenja novih rastlinskih vrst.
Z njim sta raziskovalki odprli vrata novim raziskavam in odkritjem, žal pa tudi zlorabam. V zgolj osmih letih po odkritju je njuna tehnika, preprosta za uporabo in čudežna po učinkih, preoblikovala znanost o življenju, zaostrila pa je tudi vprašanje spoštovanja etike v raziskavah. Biokemikom in celičnim biologom je omogočila raziskovanje različnih genov in njihovo možno vlogo v različnih boleznih, od raka do dednih bolezni, omogočila je na primer prirejanje rastlin tako, da prenesejo hude suše, ki so vse pogostejše v zadnjih letih, ki jih opredeljuje globalno segrevanje ozračja. Omogočila pa je tudi prirejanje bodočega in vseh naslednjih potomcev, torej ustvarjanje super človeka, če bi te škarje dobil v roke raziskovalec, ki ne bi spoštoval etičnih načel.
Usodno srečanje v portoriški kavarni
Ko sta se raziskovalki leta 2011 na znanstvenem kongresu v Portoriku dogovorili za srečanje ob kavi v odmoru med konferenco, nista niti slutili, da se bo iz tega srečanja v manj kot desetih letih rodila revolucionarna tehnika CRISPR, ki ju bo privedla do najbolj prestižne znanstvene nagrade in tudi do velikih skrbi, kako preprečiti njene zlorabe. Tehnika, ki sta jo razvili, namreč lahko posega v samo dedno zasnovo – njeni učinki so trajni in se prenašajo iz roda v rod.
Da kava med odmorom na konferenci ni bila zgolj kava, ampak se je srečanje nadaljevalo s sodelovanjem v raziskovanju, ima zasluge Emmanuellle Carpenter. Med sodelavci in znanci velja za zagnano osebo, pozorno in temeljito, nekateri pa celo pravijo, da vedno išče nepričakovano – da se torej podaja na neznane poti in za novimi cilji. Za to pa je bilo seveda ključnega pomena, da je bila svobodna in neodvisna. Tako ni presenetljivo, da je po doktoratu na Pasteurjevem inštitutu v Parizu živela in raziskovala v kar petih različnih državah, sedmih mestih in delala v desetih različnih institucijah.
Njeno raziskovalno okolje in pristopi so se spreminjali, ena stalnica pa jo je ves čas spremljala: patogene bakterije. Mučilo jo je vprašanje, zakaj so ti prostemu očesu nevidni in številni organizmi tako agresivni? Kako razvijejo odpornost proti antibiotikom? In ali je mogoče najti nove načine zdravljenja, ki lahko zaustavijo njihov napredek?
Vznemirljiva bakterija Streptococcus pyogenes
Leta 2002, ko je Emmanuelle Charpentier ustanovila svojo raziskovalno skupino na dunajski univerzi, se je osredotočila na eno od bakterij, ki človeštvu povzroča največ škode: Streptococcus pyogenes. Ta bakterija vsako leto okuži milijone ljudi, bodisi z zlahka ozdravljivimi okužbami, kot sta tonzilitis in impetigo, lahko pa povzroči tudi smrtno nevarno sepso in razgradi mehka tkiva v telesu, zaradi česar je znana tudi kot »mesojeda bakterija«. Da bi jo bolje razumela, je začela temeljito raziskovati razporejenost njenih genov, kar je bil prvi korak na poti do »genskih škarij«.
V medicini genske škarje prispevajo k novim imunoterapijam raka, potekajo tudi poskusi za uresničitev idej, ki so dolgo veljale za neuresničljive – za zdravljenje dednih bolezni. Razvijajo tudi metode za popravilo genov v velikih organih, kot so možgani in mišice.
V tistem času je Jennifer Doudna na drugi strani Atlantika prvikrat slišala kratico, za katero se ji je zdelo, da zveni kot ostrina. Že ko je kot otrok odraščala na Havajih, jo je vznemirjalo odkrivanje neznanega. Oče, ki je to njeno željo podpiral, ji je na posteljo položil knjigo Jamesa Watsona Dvojna vijačnica, v detektivskem slogu napisano zgodbo o tem, kako sta James Watson in Francis Crick rešila strukturo molekule DNK. Knjiga je Jennifer očarala in jo usmerila v odločitev, da bo znanstvena raziskovalka.
Bakterije imajo starodaven imunski sistem
Ko je začela reševati znanstvene skrivnosti, njena pozornost ni bila usmerjena na DNK, temveč na njeno molekularno sestro RNK. Leta 2006 – ko je Emmanuelle Carpentier na Dunaju raziskovala razporeditev genov v bakteriji Streptococcus pyogenes, je Jennifer Doudna, z dvema desetletjema izkušenj z delom z RNK, vodila raziskovalno skupino na Kalifornijski univerzi v Berkeleyju. Bila je znana kot uspešna raziskovalka, ki ima nos za prelomne projekte in ki se je malo pred tem podala na razburljivo novo področje: interferenco RNK.
Raziskovalci so bili že nekaj let prepričani, da razumejo osnovno funkcijo RNK, vendar so prav tedaj nepričakovano odkrili veliko majhnih molekul RNK, ki pomagajo uravnavati gensko aktivnost v celicah. Takrat je Jennifer Doudna, ki se je podala na področje interference RNK, poklical kolega mikrobiolog z drugega oddelka. Povedal ji je o novem odkritju, in sicer, da ko so primerjali genski material zelo različnih bakterij in arhej (vrste mikroorganizmov), so odkrili ponavljajoča se zaporedja DNK, ki so presenetljivo dobro ohranjena. Ista koda se je pojavljala znova in znova, vendar so se unikatna zaporedja med ponovitvami razlikovala. V bistvu so odkrili nekaj podobnega, kot če bi se ista beseda ponavljala v vseh posameznih stavkih v knjigi.
Te nize ponavljajočih se zaporedij so imenovali clustered regularly interspaced short palindromic repeats (gručaste, redno medsebojno razporejene kratke palindromne ponovitve), s kratico so jih označili kot CRISPR. Zanimivo pri tem je, da se ta unikatna, neponavljajoča se zaporedja v CRISPR ujemajo z genetsko kodo različnih virusov, zato so znanstveniki to imeli za delo starodavnega imunskega sistema, ki ščiti bakterije in arheje pred virusi.
Hipoteza je bila, da če je bakteriji uspelo preživeti virusno okužbo, je dodala v svoj genom del genetske kode virusa kot spomin na okužbo. Kolega ji je še omenil, da nihče ne ve, kako vse to deluje, a zdi se, da je mehanizem, ki ga bakterije uporabljajo za nevtralizacijo virusa, podoben mehanizmu, ki ga je proučevala Jennifer Doudna, in sicer interferenca RNK.
Ta izjemna in vznemirljiva novica je spodbudila radovednost Doudnove in vso svojo pozornost je usmerila v sistem CRISPR. Ugotovila je, da so raziskovalci poleg zaporedij CRISPR odkrili tudi posebne gene, ki so jih poimenovali s CRISPR, okrajšano kot Cas. Doudnovi se je zdelo zanimivo, da so ti geni zelo podobni genom, ki kodirajo že znane beljakovine, specializirane za odvijanje in rezanje DNK. Ali imajo proteini Cas enako funkcijo, se je vprašala. Ali cepijo virusno DNK?
V nekaj letih intenzivnega raziskovanja ji je s svojo raziskovalno skupino uspelo razkriti delovanje več različnih proteinov Cas. Ta sistem so tedaj raziskovali tudi še na nekaj drugih univerzah. Ugotovili so, da ima imunski sistem bakterij lahko zelo različne oblike. Sistem CRISPR/Cas, ki ga je preučevala Jennifer Doudna, spada v razred 1; gre za zapleteno zadevo, ki za razorožitev virusa zahteva veliko različnih proteinov Cas. Sistemi razreda 2 so bistveno preprostejši, ker potrebujejo manj beljakovin. In na drugem koncu sveta je Emmanuelle Charpentier prav tedaj naletela na tak sistem. Tedaj, bilo je leta 2009, je živela na severu Švedske in raziskovala na univerzi Umea. Kratki dnevi in dolge noči na severu, na katere so jo opozarjali prijatelji pred selitvijo na Švedsko, je niso motili. Nasprotno, obetala si je več miru za raziskovanje.
Nov in neznan del sestavljanke sistema CRISPR
Charpentierjevo so zanimale majhne molekule RNK, ki uravnavajo gene, in v sodelovanju z raziskovalci v Berlinu je preslikala majhne RNK, ki so v S. pyogenes. Rezultati ji niso dali miru, saj je bila ena od majhnih molekul RNK, za katero se je izkazalo, da obstaja v velikih količinah, še neznana različica, genetska koda te RNK pa je bila zelo blizu svojevrstnemu zaporedju CRISPR v genomu bakterije. Zaradi podobnosti med njima je Emmanuelle Charpentier posumila, da sta povezani. Skrbna analiza njunih genetskih kod ji je razkrila, da se je en del majhne in neznane molekule RNK ujemal s ponovljenim delom CRISPR – kot da bi našli kosa sestavljanke, ki se popolnoma prilegata.
Charpentierjeva ni nikoli pred tem raziskovala CRISPR, vendar je njena raziskovalna skupina razrešila nekaj pomembnih mikrobioloških ugank, da bi preslikala sistem CRISPR v bakteriji S. pyogenes. Za ta sistem, ki spada v razred 2, je bilo že znano, da potrebuje samo en protein Cas, Cas9, za cepitev virusne DNK. Charpentierjeva je ugotovila, da ima odločilno funkcijo tudi neznana molekula RNK, ki se imenuje transaktivacijska crispr RKA (tracrRNA); potrebna je, da dolga RNK, ki je ustvarjena iz zaporedja CRISPR v genomu, dozori v svojo aktivno obliko.
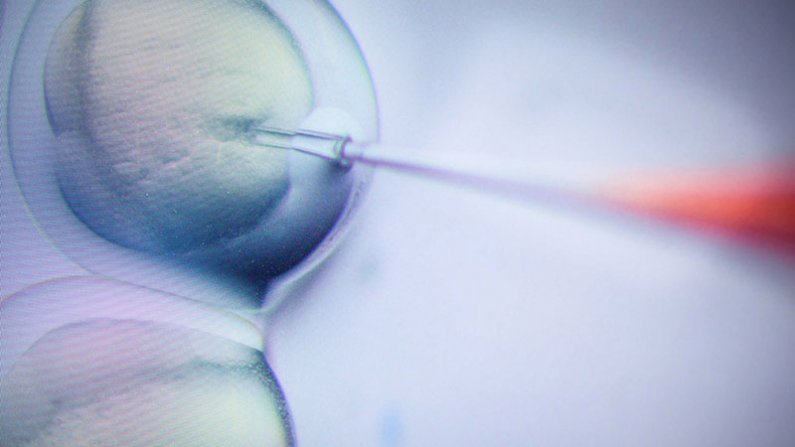
Slika: Vbrizgavanje celice celice z molekulami CRISPR/Cas9 v eksperimentu za urejanje genoma
Po intenzivnem in ciljnem eksperimentiranju je Emmanuelle Charpentier marca leta 2011 objavila svoje odkritje tracrRNK. Slutila je, da je na poti do nečesa velikega in da kot mikrobiologinja potrebuje na področju CRISPR sodelovanje biokemika. Da bi bila najbolj primerna Jennifer Doudna s Kalifornijske univerze, ji ni bilo težko ugotoviti. Zato je sprejela vabilo na konferenco v Portoriku, kjer naj bi predstavila svoje delo – njen cilj pa je bil predvsem srečati raziskovalko Jennifer Doudna.
Začetek odločilnega sodelovanja
Naključje je hotelo, da sta se raziskovalki srečali na kavi že drugi dan konference. Dogovorili sta se, da se bosta naslednji dan skupaj odpravili raziskovat osrčje stare prestolnice, a namesto zgodovine kraja je beseda stekla o njunem raziskovalnem delu. Emmanuelle je Jennifer vprašala, ali bi jo zanimalo sodelovati v raziskavi funkcije Cas9 v bakteriji S. pyogenes.
Iz pohoda po starih, s kamnom tlakovanih ulicah Portorika se je rodilo eno najbolj plodnih znanstvenih sodelovanj v zadnjem desetletju, ki je bilo letos okronano z Nobelovo nagrado za kemijo. A pot, čeprav kratka, ni bila gladka in lahka. Znanstvenici sta slutili, da je CRISPR-RNK potrebna za identifikacijo DNK virusa in da so Cas9 škarje, ki lahko izrežejo molekulo DNK. Toda ko sta to hipotezo preizkusili in vitro, se ni zgodilo nič. Molekula DNK je ostala nedotaknjena. Zakaj? Je bilo kaj narobe z eksperimentalnimi razmerami? Ali pa ima Cas9 morda povsem drugačno funkcijo? Odgovor se je skrival v tracrRNK – šele ta je omogočil cepitev molekule DNK na dva dela.
Evolucijske rešitve so raziskovalce pogosto presenetile, a to, do česar sta prišli Jennifer Doudna in Emmanuelle Carpenter, je bilo nekaj izjemnega. Orožje, ki so ga streptokoki razvili kot zaščito pred virusi, je delovalo preprosto, učinkovito in celo briljantno. Zgodovina genskih škarij bi se tu lahko ustavila; znanstvenici sta odkrili temeljni mehanizem v bakteriji, ki človeštvu povzroča veliko trpljenje. To odkritje je bilo samo po sebi presenetljivo in izjemno, toda ni bilo zadnja in odločilna postaja v njunem raziskovalnem sodelovanju.
Odločili sta se, da bosta te enkratne genske škarje poskušali še poenostaviti. Z novim znanjem o tracr-RNK in CRISPR-RNK sta ugotovili, kako jih združiti v eno molekulo, ki sta jo poimenovali vodilna RNK. S to poenostavljeno različico genskih škarij sta nato naredili epohalni eksperiment: raziskali sta, ali lahko nadzirata to gensko orodje tako, da razreže DNK na mestu, ki sta ga določili. Na genu, ki je bil že v zamrzovalniku v laboratoriju Jennifer Doudna, sta izbrali pet različnih mest, kjer naj bi gen cepili. Nato sta spremenili del škarij CRISPR tako, da se je koda ujemala s kodo, kjer naj bi bili narezani kosi. Rezultat, ki sta ga dobili, je bil prebojen. Molekule DNK so bile razcepljene na točno vnaprej določenih mestih.
Genske škarje spreminjajo znanosti o življenju
Kmalu po tem, ko sta Emmanuelle Charpentier in Jennifer Doudna leta 2012 objavili odkritje genskih škarj CRISPR / Cas9, je več raziskovalnih skupin dokazalo, da je to orodje mogoče uporabiti za spreminjanje genoma v celicah miši in ljudi. Vrata za eksplozivni razvoj so bila tako odprta.
Do tedaj je bila sprememba genov v celici, rastlini ali organizmu dolgotrajna in velikokrat tudi nemogoča. Z uporabo genskih škarij pa lahko raziskovalci – načeloma – režejo kateri koli genom, ki ga želijo, in naravne sisteme celice enostavno uporabijo za popravilo DNK. Ker je to gensko orodje tako enostavno za uporabo, je zdaj razširjeno v temeljnih raziskavah. Uporablja se za spreminjanje DNK celic in laboratorijskih živali, da bi razumeli, kako različni geni delujejo in medsebojno vplivajo drug na drugega, na primer, med boleznijo.
Genske škarje so postale tudi standardno orodje v vzreji rastlin. Metode, ki so jih raziskovalci že uporabljali za spreminjanje rastlinskih genov, so pogosto zahtevale dodajanje genov za odpornost proti antibiotikom. Ko smo posejali posevke, je obstajala nevarnost, da se ta odpornost proti antibiotikom razširi na okoliške mikroorganizme. Po zaslugi genskih škarij pa raziskovalcem zdaj ni treba uporabljati teh starejših metod. Med drugim so uredili gene, zaradi katerih riž absorbira težke kovine iz tal, kar vodi do izboljšanih sort riža z nižjo vsebnostjo kadmija in arzena. Raziskovalci so razvili tudi pridelke, ki bolje prenašajo sušo v toplejšem podnebju in se upirajo žuželkam in škodljivcem, s katerimi bi se sicer morali spoprijeti s pesticidi.
Upanje, da bomo kos dednim boleznim
V medicini genske škarje prispevajo k novim imunoterapijam raka, potekajo poskusi za uresničitev idej, ki so dolgo veljale za neuresničljive – za zdravljenje dednih bolezni. Raziskovalci že izvajajo klinična preizkušanja, da bi raziskali, ali lahko CRISPR/Cas9 uporabljajo za zdravljenje krvnih bolezni, kot so srpastocelična anemija in beta talasemija, pa tudi dednih očesnih bolezni.
Genske škarje se odlikujejo s številnimi prednostmi, imajo pa tudi eno veliko hibo: razmeroma zlahka jih je zlorabiti. To orodje lahko na primer uporabimo za ustvarjanje gensko spremenjenih zarodkov.
Razvijajo tudi metode za popravilo genov v velikih organih, kot so možgani in mišice. Poskusi na živalih so pokazali, da lahko posebej zasnovani virusi dostavijo genske škarje do želenih celic, pri čemer zdravijo modele uničujočih dednih bolezni, kot so mišična distrofija, mišična atrofija hrbtenice in Huntingtonova bolezen. Vendar pa je treba tehnologijo še izboljšati, preden jo bo mogoče preizkusiti na ljudeh.
Kako preprečiti zlorabo
Genske škarje se odlikujejo s številnimi prednostmi, imajo pa tudi eno veliko hibo: razmeroma zlahka jih je zlorabiti. To orodje lahko na primer uporabimo za ustvarjanje gensko spremenjenih zarodkov. Vendar že vrsto let obstajajo zakoni in predpisi, ki nadzorujejo uporabo genskega inženiringa, ki vključujejo prepovedi spreminjanja človeškega genoma na način, ki omogoča podedovanje sprememb. Tudi poskusi, ki vključujejo ljudi in živali, morajo etični odbori pred njihovo izvedbo vedno pregledati in odobriti.
»Gotovo je eno: te genske škarje vplivajo na vse nas. Soočili se bomo z novimi etičnimi vprašanji, vendar bo to novo orodje lahko prispevalo k reševanju številnih izzivov, s katerimi se sooča človeštvo. S svojim odkritjem sta Emmanuelle Charpentier in Jennifer Doudna razvili kemično orodje, ki je znanosti o življenju popeljalo v novo obdobje. Zaradi njih smo se zazrli v široko obzorje neslutenega potenciala in med potjo – med raziskovanjem te nove dežele – bomo zagotovo našli nova in nepričakovana odkritja,« so optimistični v odboru za Nobelove nagrade.
Članek je bil objavljen v reviji Gea (december 2020)







